Spätestens seit der COVID-19-Pandemie ist der Begriff mRNA im Zusammenhang mit Impfstoffen in aller Munde. mRNAs oder Boten-RNAs dienen dazu, die in der DNA gespeicherte genetische Information in Proteine zu übersetzen. Tatsächlich machen diese proteinkodierenden RNAs jedoch nur einen sehr kleinen Teil des menschlichen Transkriptoms aus. Der überwiegende Teil der RNAs wird daher als nicht-kodierende RNAs (ncRNAs) klassifiziert, die als funktionelle RNA-Moleküle eine Vielzahl biologischer Prozesse regulieren. Neben den bereits bekannten microRNAs (miRNAs) und den langen nicht-kodierenden RNAs (lncRNAs) konnte durch den Einsatz neuer bioinformatischer Hochdurchsatzanalysen in der Transkriptomsequenzierung eine weitere Klasse von ncRNAs identifiziert werden, die als ringförmig geschlossene RNA-Moleküle vorliegen, die sogenannten zirkulären RNAs (circRNAs).
Zirkuläre RNAs kommen zu Tausenden in jeder Zelle vor, wobei deren Funktionen noch überwiegend unbekannt sind. Aufgrund ihrer Fähigkeit, mit anderen Biomolekülen wie miRNAs, mRNAs und Proteinen zu interagieren, werden circRNAs jedoch zunehmend als wichtige Regulatoren der Genexpression angesehen, die eine wichtige Rolle bei der Entstehung von Krankheiten spielen. Da sie durch rekombinant hergestellte circRNAs oder durch Antisense-Oligonukleotide an- oder abgeschaltet werden können, bieten sie möglicherweise innovative Ansatzpunkte für die Entwicklung neuer therapeutischer Strategien.
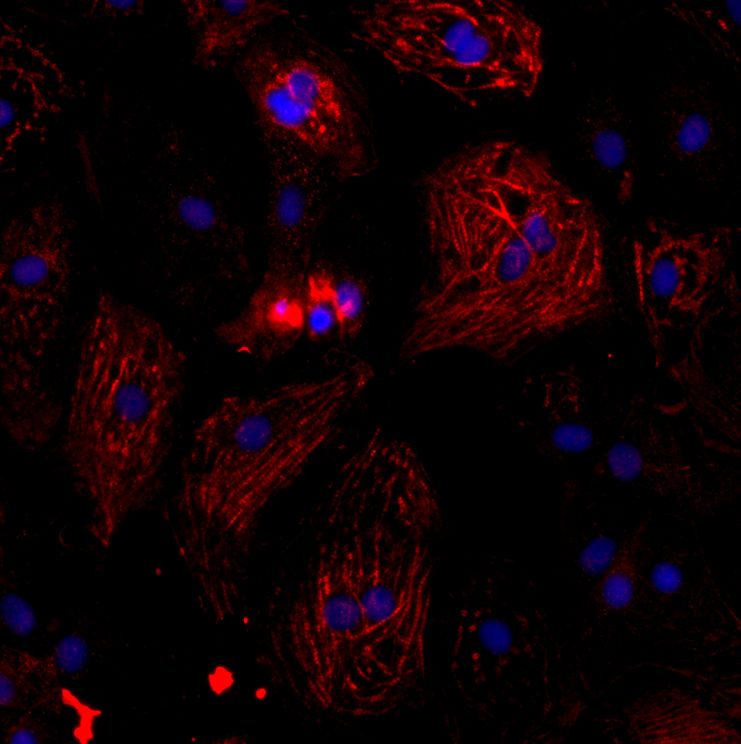
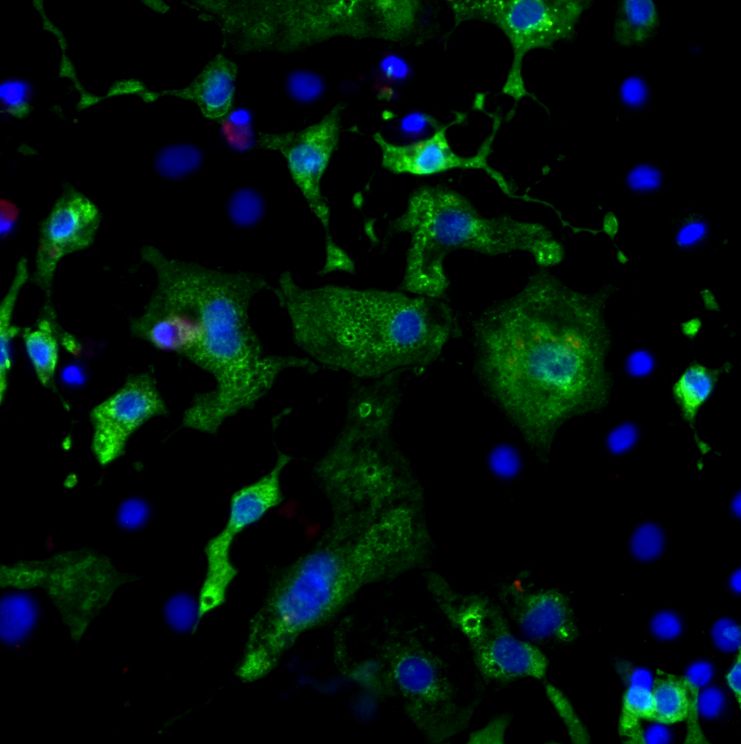
Im Rahmen der Plattform »RNA-Therapeutika« des Fraunhofer Cluster of Excellence Immune-Mediated Diseases CIMD fokussieren sich die Forschenden auf die Untersuchung von circRNAs in menschlichen Herzmuskelzellen nach einer SARS-CoV-2-Infektion. Herzmuskelzellen werden neben Lungenzellen ebenfalls stark von SARS-CoV-2 befallen und es konnte gezeigt werden, dass kardiovaskuläre Vorerkrankungen mit einem stark erhöhten Risiko für schwere und tödliche COVID-19-Verläufe assoziiert sind. Das Forschungsteam konnte bereits verschiedene circRNAs identifizieren, die eine wichtige Rolle bei der Infektion von Herzmuskelzellen mit SARS-CoV-2 zu spielen scheinen. Das gezielte Ausschalten einer spezifischen circRNA, die sie circCOV-1 getauft haben, durch inhibitorische Antisense-Oligonukleotide führte zu einer deutlichen Reduktion der Viruslast. Derzeit führen die Wissenschaftler mechanistische Studien durch, um zu klären, ob die Inhibierung von circCOV-1 SARS-CoV-2 am Zelleintritt hindert oder ob die Vermehrung des Virus innerhalb der Herzmuskelzelle gestört wird.
 Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
Fraunhofer-Institut für Toxikologie und Experimentelle Medizin