Nahtlos aus der Idee ein steriles Prüfarzneimittel entwickeln
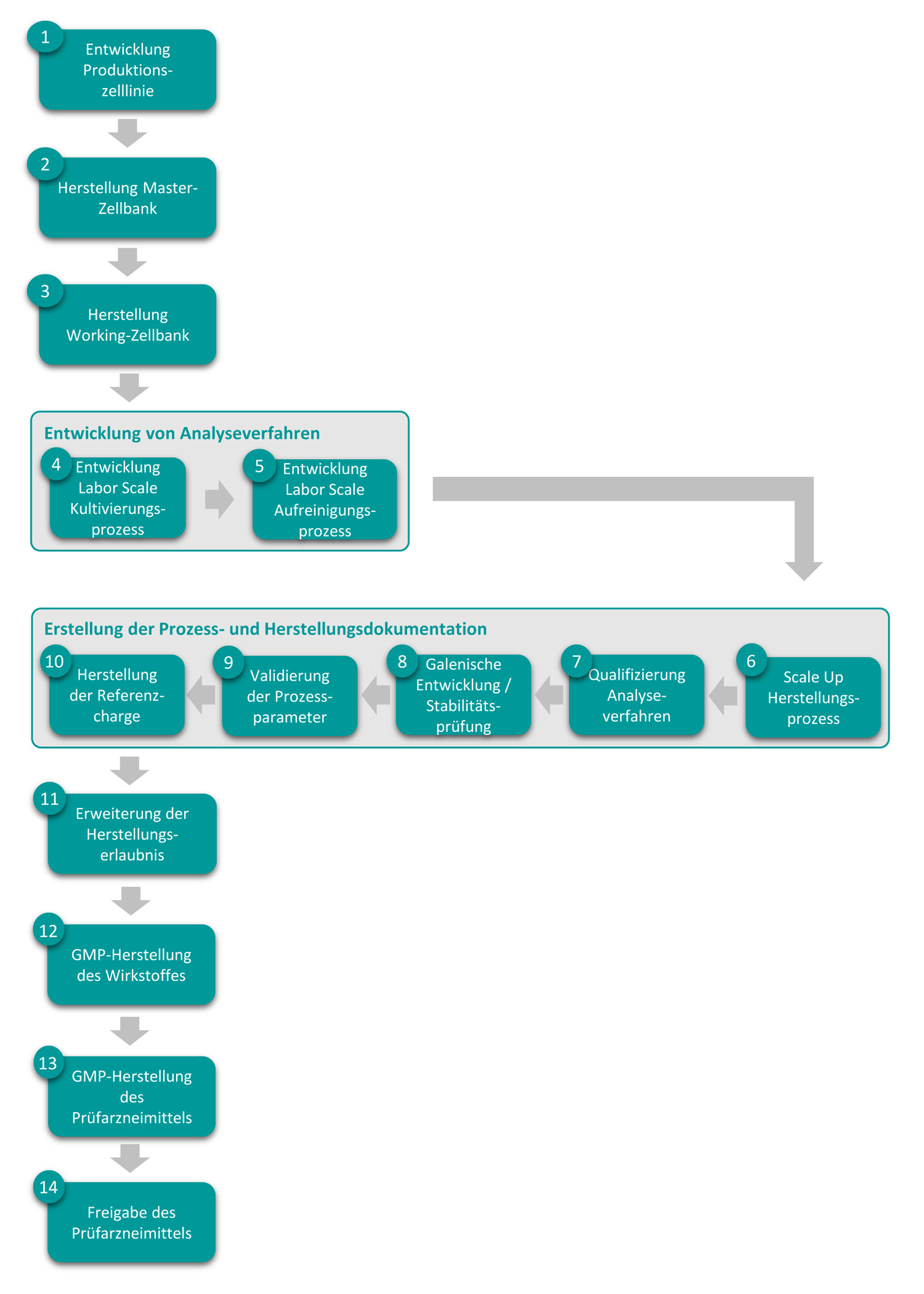
Das Fraunhofer ITEM hat über 25 Jahre Erfahrung in der Entwicklung biopharmazeutischer Herstellungsprozesse bis hin zur GMP-konformen Herstellung von Wirkstoffen und Prüfarzneimitteln für klinische Prüfungen. Ein multidisziplinäres Team aus Biologen, Chemikern, Pharmazeuten, Ingenieuren und Technikern unterstützt und begleitet Sie auf dem Weg von Ihrer Idee für ein neues Biopharmakon über die Zelllinienentwicklung bis zur Herstellung Ihres für die klinische Prüfung freigegebenen Prüfarzneimittels. Dabei bieten wir Ihnen unsere Dienstleistungen je nach Bedarf für die gesamte Entwicklungskette oder auch nur für einzelne Schritte an.
- Wir stehen Ihnen mit dem Know-how zur Seite, das wir uns über die Jahre hinweg bei einer Vielzahl von Biopharmakaprojekten – von rekombinanten Proteinen und Glykoproteinen bis zu komplexen multimolekularen Strukturen wie Viren und Zellen – erworben haben.
- Wir liefern Ihnen Wirkstoffe und Prüfarzneimittel und begleiten Sie im regulatorischen Prozess bis hin zur Genehmigung des »Investigational Medicinal Product Dossiers« (IMPD) für Ihr Prüfpräparat.
- Wir begleiten Sie auf dem Weg von der Idee für ein neues Biopharmakon über die Zelllinienentwicklung bis zur Herstellung des für die klinische Prüfung freigegebenen Prüfarzneimittels.
 Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
Fraunhofer-Institut für Toxikologie und Experimentelle Medizin