In den letzten Jahren wurden große Fortschritte in der Krebstherapie erzielt, die zu einem großen Teil auf der Entwicklung neuartiger Immuntherapien beruhen. Dazu gehören vor allem Behandlungen mit monoklonalen Antikörpern oder Zelltherapeutika wie CAR-T-Zellen, die sich direkt gegen Tumorzellen richten. Es hat sich jedoch gezeigt, dass diese Therapien – wie auch »konventionelle« Krebstherapien mit Anthrazyklinen oder Tyrosin-Rezeptor-Kinasen – häufig kardiotoxische Eigenschaften aufweisen und zu Herzinsuffizienz führen können. Auf der einen Seite sind die neuen Therapien ein Segen, der es immer mehr Patienten ermöglicht, den Krebs zu besiegen, auf der anderen Seite stellt die Kardiotoxizität dieser Therapien, die zum Teil erst nach Jahren auftreten kann, ein zunehmendes klinisches Problem dar.
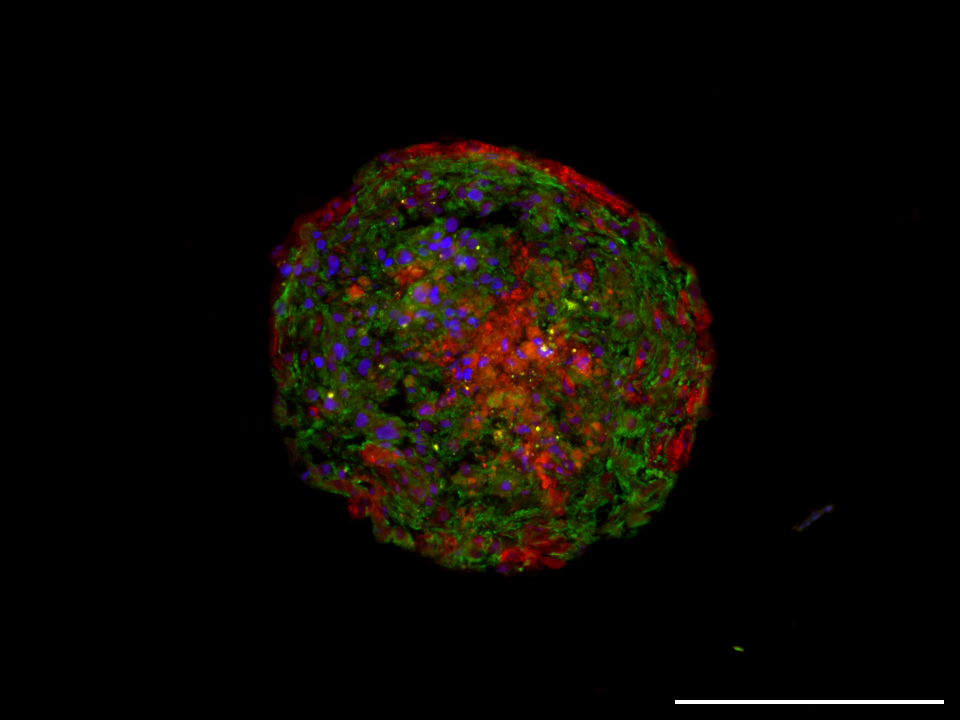
Die potenzielle Kardiotoxizität neuer Immun- und Zelltherapeutika kann in herkömmlichen Zellkulturen aufgrund der notwendigen Komplexität nur unzureichend vorhergesagt oder simuliert werden. Um diesem Problem zu begegnen, haben Wissenschaftler an der Medizinischen Hochschule Hannover und am Fraunhofer ITEM ein neues komplexes Herz-Organoid-Modell etabliert, das die Eigenschaften des natürlichen menschlichen Herzens in seiner (patho-)physiologischen Entwicklung besser abbildet. Das Forschungsteam hat bereits erste funktionelle Organoide hergestellt. Sie bestehen aus Kardiomyozyten, kardialen Fibroblasten, Endothelzellen, die von induzierten pluripotenten menschlichen Stammzellen (hiPSC) stammen, sowie aus Stammzellen, die aus Fettgewebe abgeleitet sind. Diese bilden funktionelle Mini-Herzstrukturen, die spontan schlagen oder durch Elektrostimulation ähnlich einem Herzschrittmacher gesteuert werden können. In Krankheitsmodellierungsansätzen konnte gezeigt werden, dass die Kontraktilität der Herzorganoide medikamentös beeinflussbar ist und die Gabe klassischer Chemotherapeutika zu einer kardiotoxischen kontraktilen Imbalance führt.
Im nächsten Schritt sollen diese Organoide um einen weiteren Zelltyp ergänzt werden. Sogenannte Stammzell-abgeleitete Designer-Immunzellen werden so den Miniherzen ein Immunsystem verleihen, um später auch die Modellierung und Testung der Kardiotoxizität durch neuartige Immun- und Zelltherapeutika zu ermöglichen.
 Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
