Patientenzugang zu Hochrisiko-Medizinprodukten verbessern
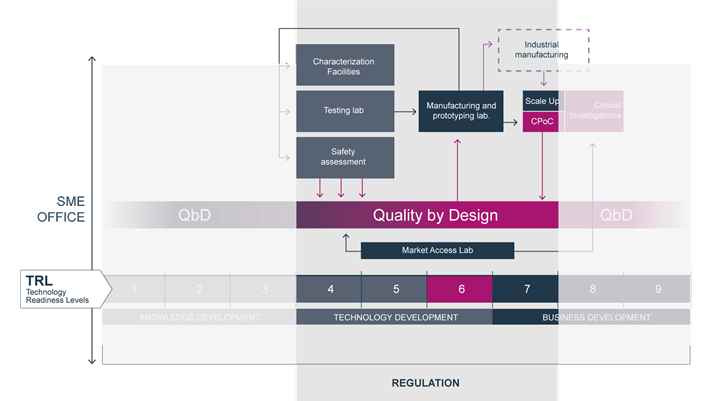
Mit dem Ziel, europäische Medizintechnikunternehmen im globalen Wettbewerb zu unterstützen, hat die EU das Projekt »TBMED – An Open-Innovation Test Bed for the Development of High-Risk Medical Devices« aufgelegt. Das Fraunhofer ITEM ist mit weiteren 12 Projektpartnern aus Spanien, Frankreich, Irland und Deutschland maßgeblich an der Entwicklung einer Testplattform für Hochrisiko-Medizinprodukte der Klassen IIb und höher beteiligt. Gefördert wird das Projekt mit 8,5 Millionen Euro aus dem EU-Rahmenprogramm Horizon 2020 und läuft bis Ende Februar 2023.
TBMED ist ein von der EU gefördertes Verbundprojekt, das darauf abzielt, den Zugang von Patienten zu Hochrisiko-Medizinprodukten zu verbessern. Zu diesem Zweck sollen KMU dabei unterstützt werden, die Zeit bis zur Markteinführung eines neuen Produkts und die Amortisationsdauer zu minimieren und somit den Translationsprozess vom Prototyp zum wertvollen innovativen Medizinprodukt zu optimieren.
 Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
Fraunhofer-Institut für Toxikologie und Experimentelle Medizin