Skalier- und anpassbare Produktion von Makrophagen für die Prüfung parenteraler Arzneistoffe im Monozyten-Aktivierungstest gemäß regulatorischen Anforderungen
Die aktuellen Bestrebungen der EDQM (European Directorate for the Quality of Medicines) und des Modernization Act 2.0 der FDA (Food and Drug Administration) zielen darauf ab, den Einsatz von Tieren oder tierischen Materialien in der Bewertung von Arzneimitteln zu eliminieren und die Entwicklung sowie Nutzung alternativer Testmethoden verpflichtend zu machen. Insbesondere wird der Kaninchen-Pyrogentest in naher Zukunft weltweit aus den Arzneibüchern ausgeschlossen.
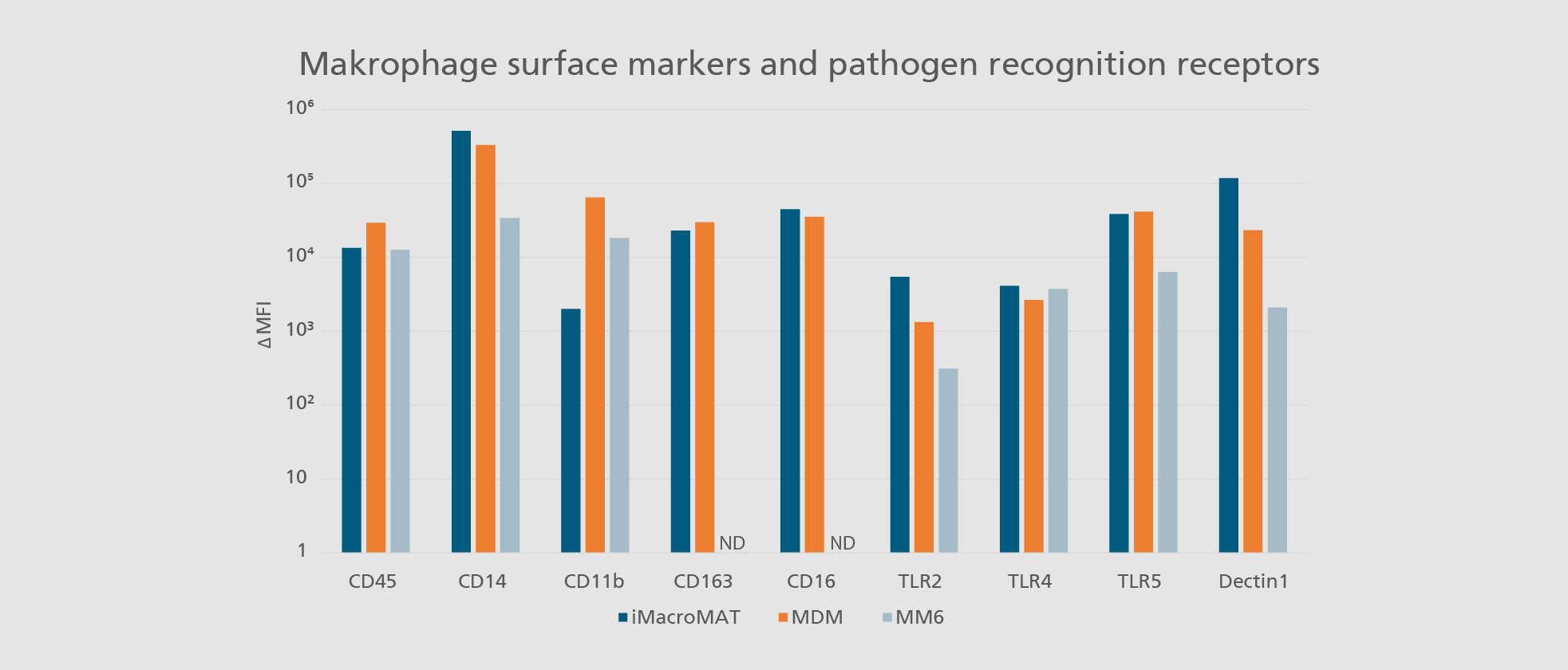
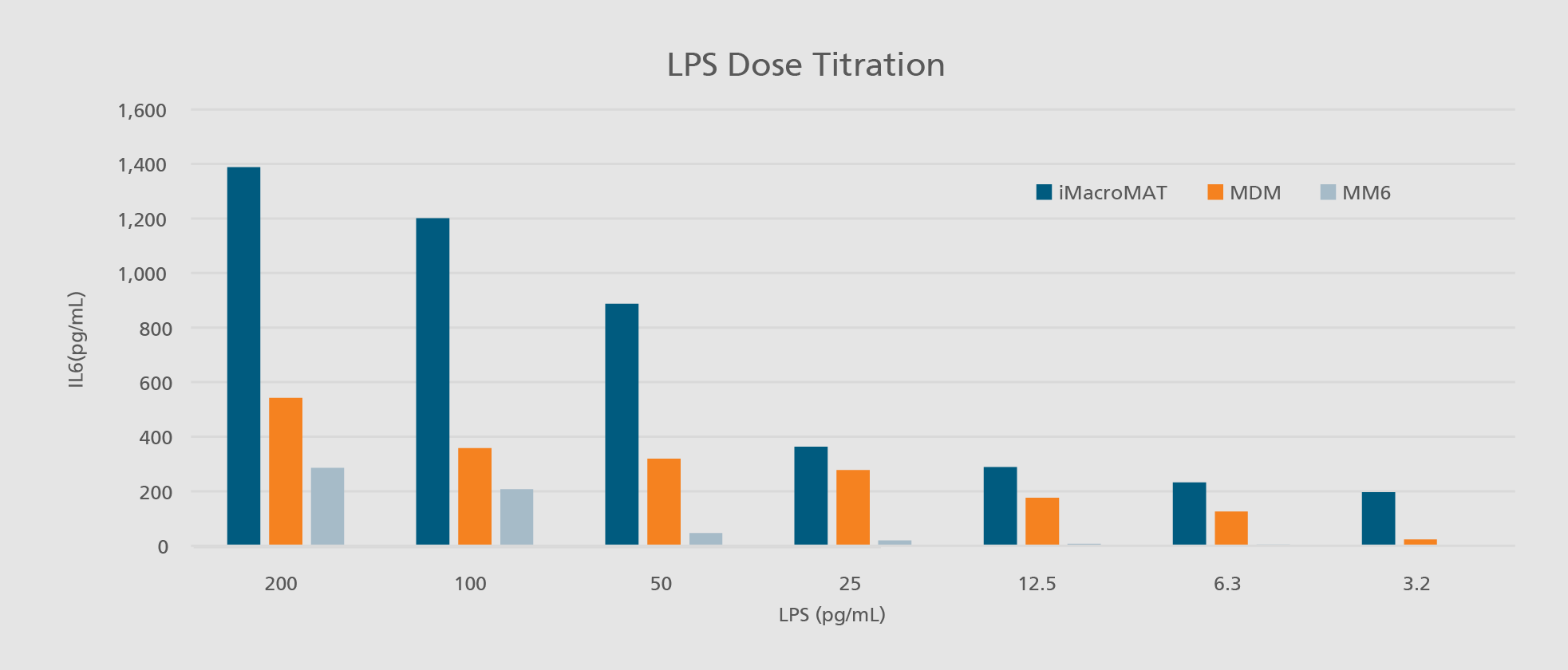
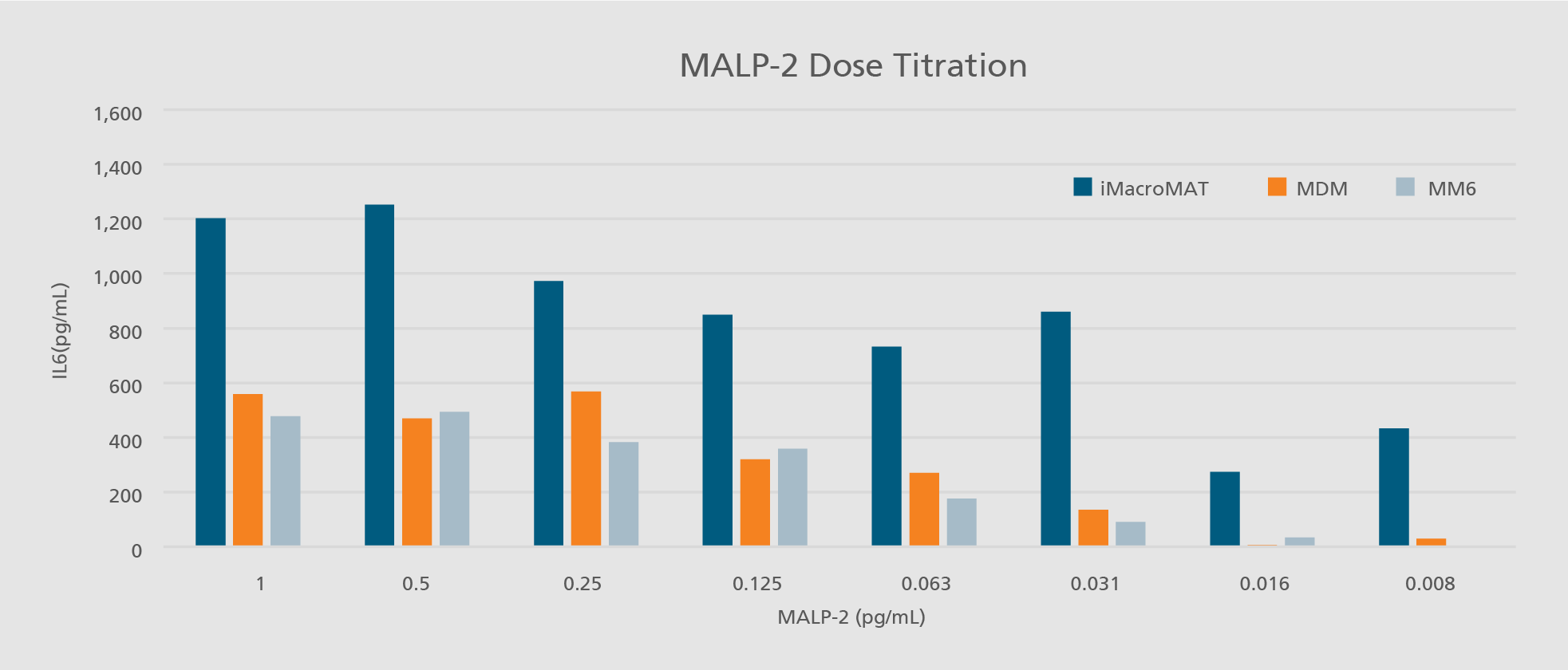
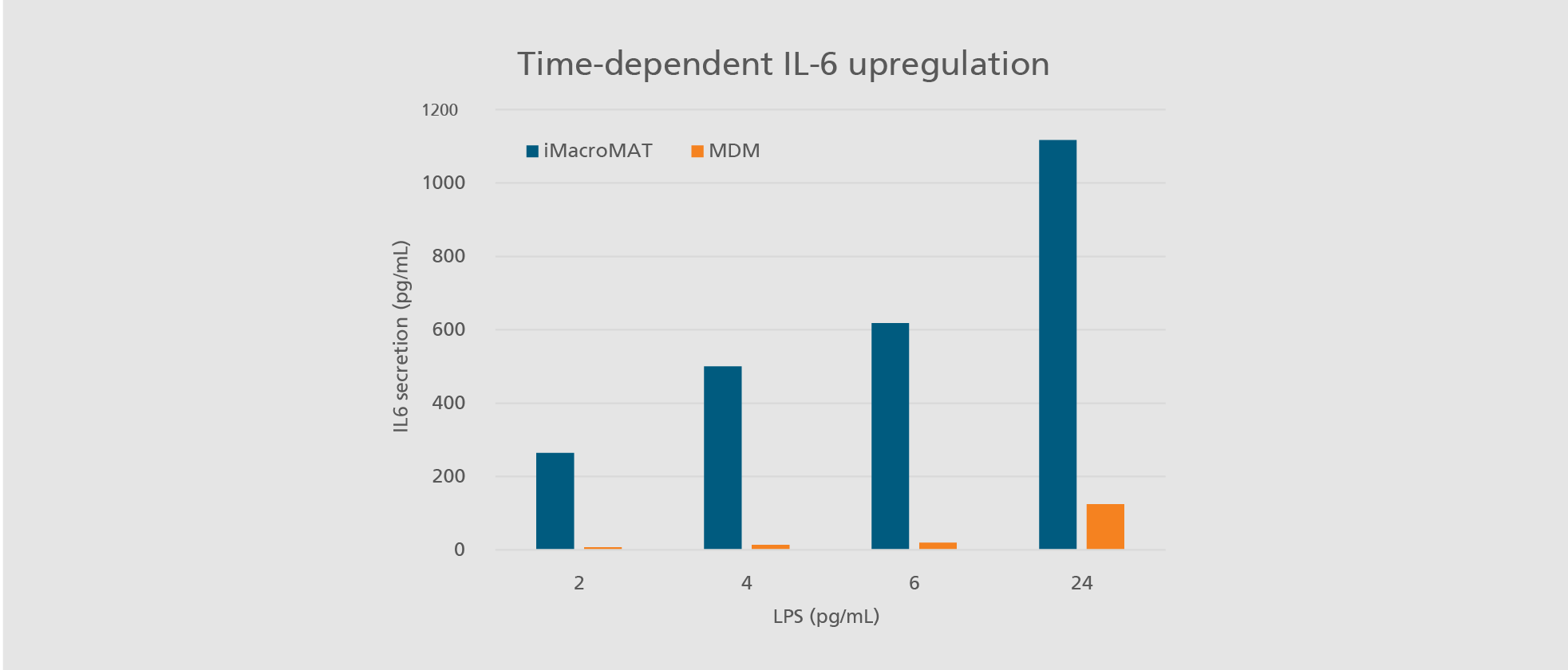
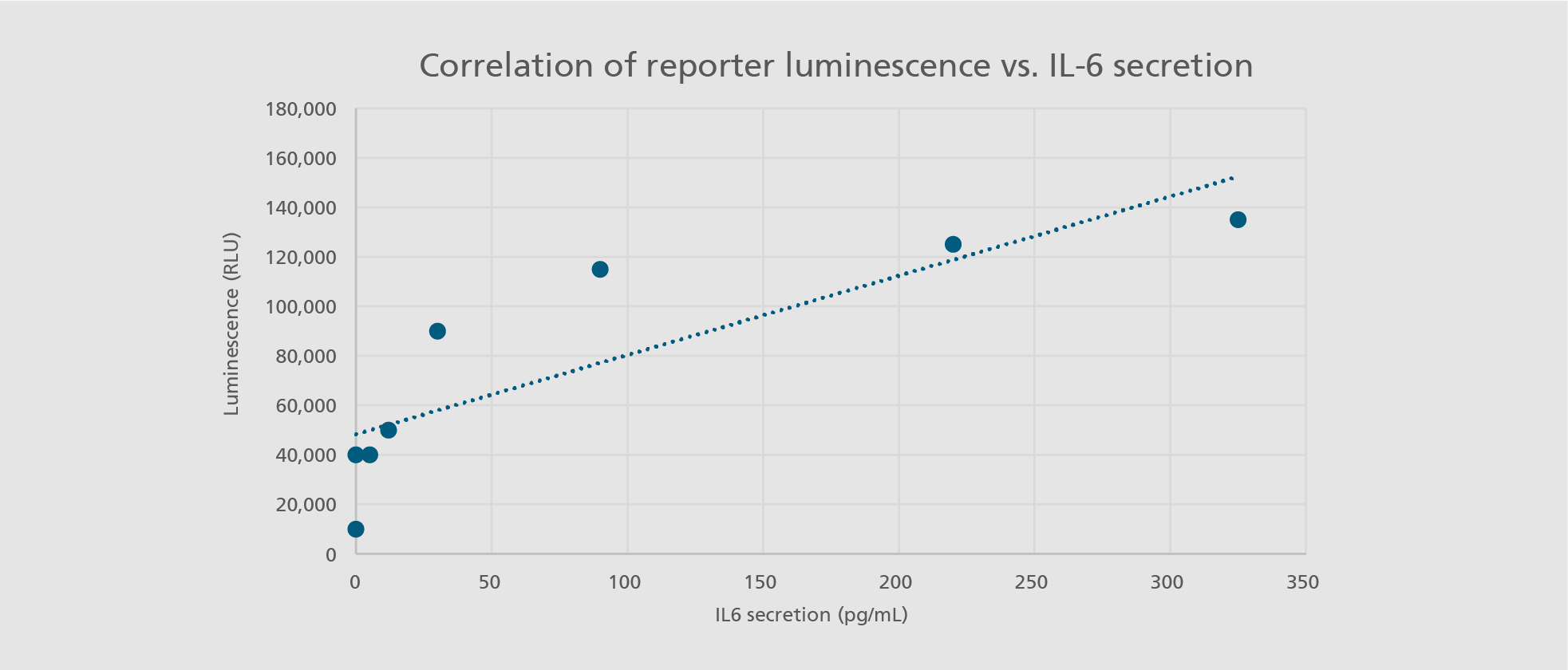
Im menschlichen Körper spielen Immunzellen, insbesondere Monozyten und Makrophagen, eine zentrale Rolle bei der Früherkennung von Krankheitserregern und der Vermittlung von Entzündungsreaktionen. Diese essenziellen Funktionen können industriell in die Entwicklung und Prüfung von Arzneimitteln integriert werden, beispielsweise im Monozyten-Aktivierungstest (MAT). Aufgrund verschiedener Nachteile primärer humaner Zellen – wie Verfügbarkeit, Standardisierbarkeit und genetische Variabilität – sind diese für die Sicherheitsbewertung parenteraler Arzneimittel nur bedingt geeignet. Zudem sind Zelllinien aufgrund ihrer nicht-physiologischen Eigenschaften häufig ungeeignet für sicherheitsrelevante Prüfungen.
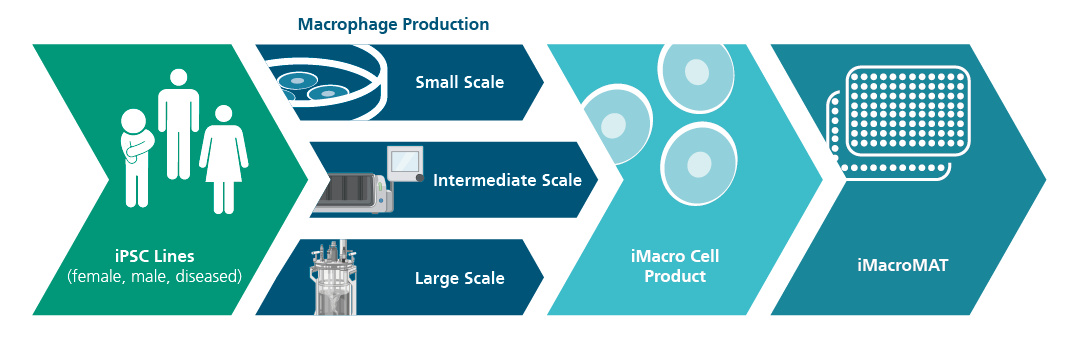
Um diese Einschränkungen zu überwinden, bieten wir die Charakterisierung und Skalierung von »Designer-Immunzellen« aus induzierten pluripotenten Stammzellen (iPSC) an. Damit stellen wir eine zuverlässige und effiziente Alternative für die Arzneimittelsicherheitsprüfung bereit, die für individuelle Zwecke maßgeschneidert werden kann.
 Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
Fraunhofer-Institut für Toxikologie und Experimentelle Medizin