Aktuelle Meldung
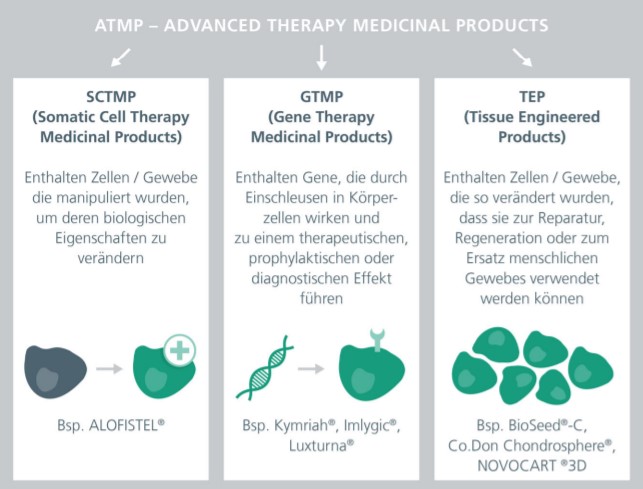
ATMPs (»advanced therapy medicinal products«) sind eine neue Klasse von Arzneimitteln, die somatische Zelltherapeutika, Gentherapeutika und biotechnologisch bearbeitete Gewebeprodukte umfassen. Bisher sind nur wenige Produkte europaweit zugelassen. Ein Grund dafür ist der langwierige und schwierige Weg ihrer Entwicklung. Vor der Anwendung beim Menschen muss in einer nichtklinischen Phase die Sicherheit des jeweiligen ATMP gezeigt werden, um potenzielle Nebenwirkungen auszuschließen. Da ATMPs biologischen Ursprungs sind und somit eine hohe Komplexität und Heterogenität aufweisen, bedarf es individueller Teststrategien. Die Entwicklung von ATMPs vom Labormaßstab zur Herstellung unter Bedingungen der »Guten Herstellungspraxis« (kurz GMP für engl. »Good Manufacturing Practice«) folgt behördlich vorgegebenen Regularien.
Um die Behandlung mit ATMPs größeren Patientengruppen zu ermöglichen, müssen GMP-Prozesse hochskaliert werden, was eine große logistische und technologische Herausforderung darstellt. Die Entwicklung von ATMPs ist kostenintensiv und zeitaufwendig, sie bieten aber auch einzigartige neue Möglichkeiten zur Behandlung schwerer Erkrankungen, wie z. B. Krebs.
Für die Zulassung eines ATMP sollten zunächst in der Regel nichtklinische Studien im regulierten Umfeld einer GLP-Prüfeinrichtung durchgeführt werden. In Deutschland besitzen neben diversen kommerziellen Anbietern fünf Institute der Fraunhofer-Gesellschaft (Fraunhofer-Institut für Biomedizinische Technik IBMT, Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB, Fraunhofer-Institut für Translationale Medizin und Pharmakologie ITMP, Fraunhofer-Institut für Toxikologie und Experimentelle Medizin ITEM, Fraunhofer-Institut für Zelltherapie und Immunologie IZI) die Zertifizierung als GLP-Prüfeinrichtung.
Aktuelle Publikation »ATMP: der Weg in die Klinik«:
Neuhaus, V., Ueberham, E., Dehmel, S. et al. ATMP: der Weg in die Klinik. Forum (2021).
Zum Artikel: https://doi.org/10.1007/s12312-021-00995-0
 Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
Fraunhofer-Institut für Toxikologie und Experimentelle Medizin