Den Bewertungsprozess mithilfe einer umfassenden Datenbank erleichtern
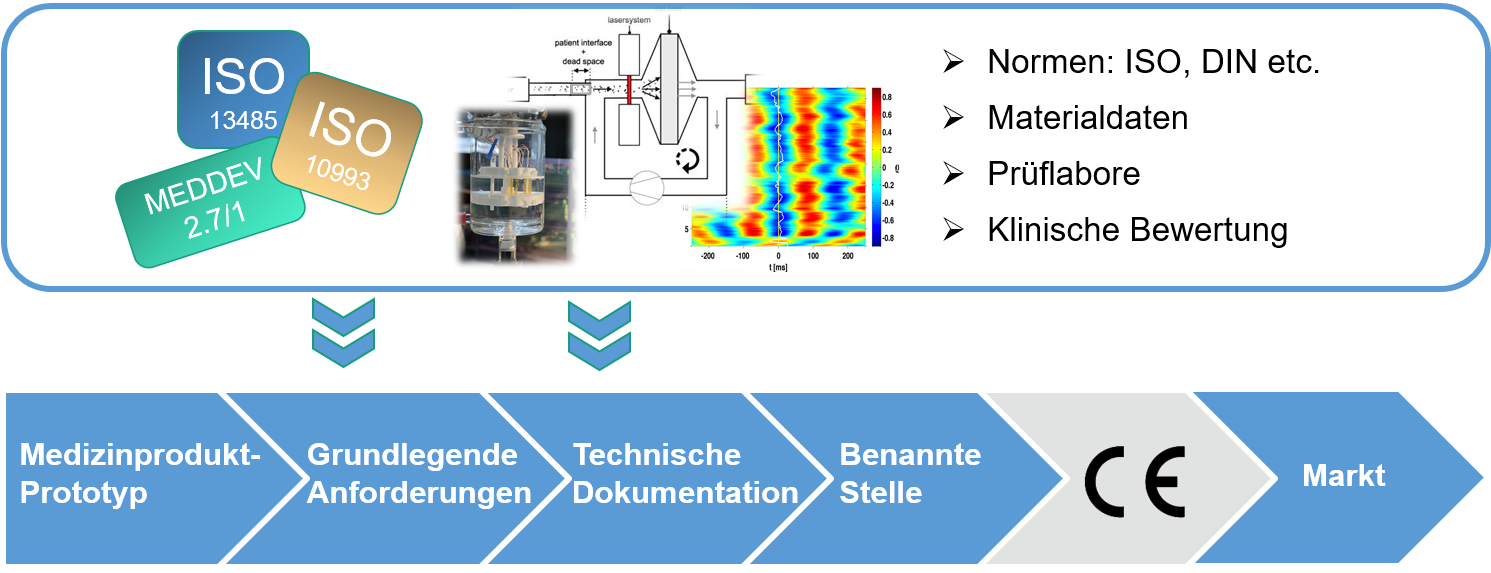
MDOT bedient den Unterstützungsbedarf der Hersteller von Medizinprodukten bei der obligatorischen Konformitätsbewertung, der durch die EU-Verordnung 2017/745 (Medical Device Regulation, kurz MDR) enorm gewachsen ist. Nach dieser Verordnung, die Ende Mai 2020 in Kraft tritt und die Medizinprodukte-Richtlinie (MDD) ablöst, müssen alle existierenden Medizinprodukte hinsichtlich ihrer Risikoklasse neu bewertet werden. Hinzu kommen eine umfangreichere Dokumentation und erhöhte Anforderungen an die klinische Prüfung. Um Medizintechnikunternehmen hierbei zu entlasten, entwickelt das Konsortium eine Plattform, die den Prozess durch Aufbau einer Datenbank mit Daten zu Regulatorik und Prüfung bis hin zur klinischen Bewertung und klinischen Studien vereinfachen soll.
Die Anwendbarkeit der Plattform soll zunächst anhand von drei Beispieltechnologien gezeigt werden: Inhalatoren für Früh- und Neugeborene, 3D-gedruckte neuronale Implantate und Beschichtungen für orthopädische Prothesen, die den Abrieb von Partikeln im Patientengewebe verringern sollen. Für diese Technologien werden Prüfsysteme entwickelt und weiter ausgebaut, um die Sicherheit und Langzeitstabilität der Geräte und Materialien sicherzustellen – was besonders bei Implantaten von großer Wichtigkeit ist. Später soll die Plattform für weitere Arten von Medizinprodukten erweitert werden.

 Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
Fraunhofer-Institut für Toxikologie und Experimentelle Medizin